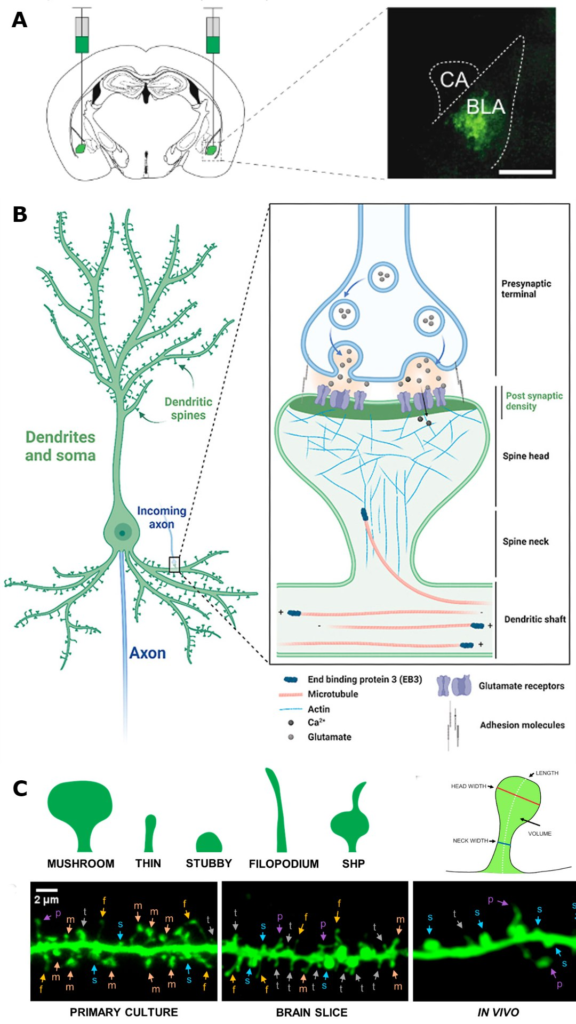
B Общий вид нейрона и синапса
C Морфология дендритных шипиков
Тревожные расстройства (включающие генерализованное тревожное расстройство, панические атаки, фобии, обсессивно-компульсивное расстройство и посттравматическое стрессовое расстройство) являются наиболее распространенными психиатрическими заболеваниями, диагностируемыми в настоящее время и поражающими ∼25% населения хотя бы раз в жизни.
Давайте совершим короткое, но головокружительное путешествие в мир нейронной архитектуры тревожной экспериментальной мыши, туда, где исследователи, возможно, нашли молекулярный тормоз тревоги. Вы наверняка слышали о миндалине (которая амигдала) – области мозга, находящейся аккурат возле гиппокампа. Она много в чём участвует, но нас интересует её роль как узла нейронной цепи ответственной за обработку пугающих стимулов и опасливого/тревожного поведения. Миндалина собирает пространственную и сенсорную информацию об окружающей среде через гиппокамп, таламус и кору головного мозга, поступающую в ее базолатеральный (снизу по бокам) отдел.
Стресс способствует росту дендритных отростков в пирамидальных нейронах в базолатеральной миндалине, что коррелирует с высокой тревожностью. То есть в ответ на события в окружающей среде происходит ремоделирование нервных клеток, которое сказывается на поведении. В нейронаучпопе гуляет расхожая фраза про то, что обучение стимулирует образование новых дендритных шипиков (dendritic spines) и потенцирование синаптической передачи (вау, нейропластичность!). А вот при долгосрочной депрессии, к примеру, количество дендритных шипиков снижается – опять-таки, перестройка нейронной архитектуры.
В статье описывается точечное эпигенетическое воздействие микроРНК (miRNA) на гены связанные со стрессом. miRNA — это небольшие некодирующие РНК (∼22 нуклеотида), которые посттранскрипционно (то есть на этапе, когда произошел этап “считывания” (транскрипция) гена, но ещё не запущен процесс “производства” соответствующего протеина (трансляция), модулируют экспрессию генов, либо подавляя трансляцию, либо вызывая деградацию матричной РНК. miRNA в изобилии присутствуют в мозге человека и (внезапно!) проявляют разнообразные регуляторные функции в центральной нервной системе (ЦНС). Одна из новых ролей miRNA заключается в клеточном ответе на стресс.
При стрессе в синаптическом отделе нейронов миндалины повышается экспрессия miR-483-5p, которая репрессирует (подавляет) три стресс-ассоциированных гена (Pgap2, Gpx3 и Macf1) через связывание с их соответствующими мРНК. То есть генетическая информация “прочитана” (ген транскрибирован), матрица для производства протеина (мРНК) есть, а вот за счёт её блокировки синтеза протеина (трансляции) не произойдёт – соответственно и “эффекта” от этого гена не будет.
Регуляция miR-483-5p приводит к избирательному сокращению дистальных (удаленных) дендритов и способствует формированию зрелых, грибовидных дендритных отростков, имеющих решающее значение для формирования, обработки и хранения эмоциональной памяти. Филоподии и “пенькообразные” (stubby) шипы незрелы и редко образуют синапсы, в то время как грибовидные шипы образуют стабильные синапсы. Это обеспечивает клеточный субстрат для стабилизации эмоционального статуса животного, делая его более устойчивым к воздействию тревожных стимулов. Таким образом, miR-483-5p может рассматриваться как молекулярный тормоз, накладываемый на стресс-индуцированную пластичность дендритных шипиков для поддержания анксиолитических поведенческих профилей.
А хорошая новость здесь в том, что как miR-483-5p, так и её «цель», расположенная в мРНК, кодирующей Pgap2, являются консервативными у различных видов. Если работает у мышей – есть надежда, что у нас работает похожим образом. А значит, можно что-то с этим делать.
