Публикация представляет из себя краткий конспект двух статей.
The role of the immune system in posttraumatic stress disorder
Inflammation and post-traumatic stress disorder
Патрон: Елена Борисова
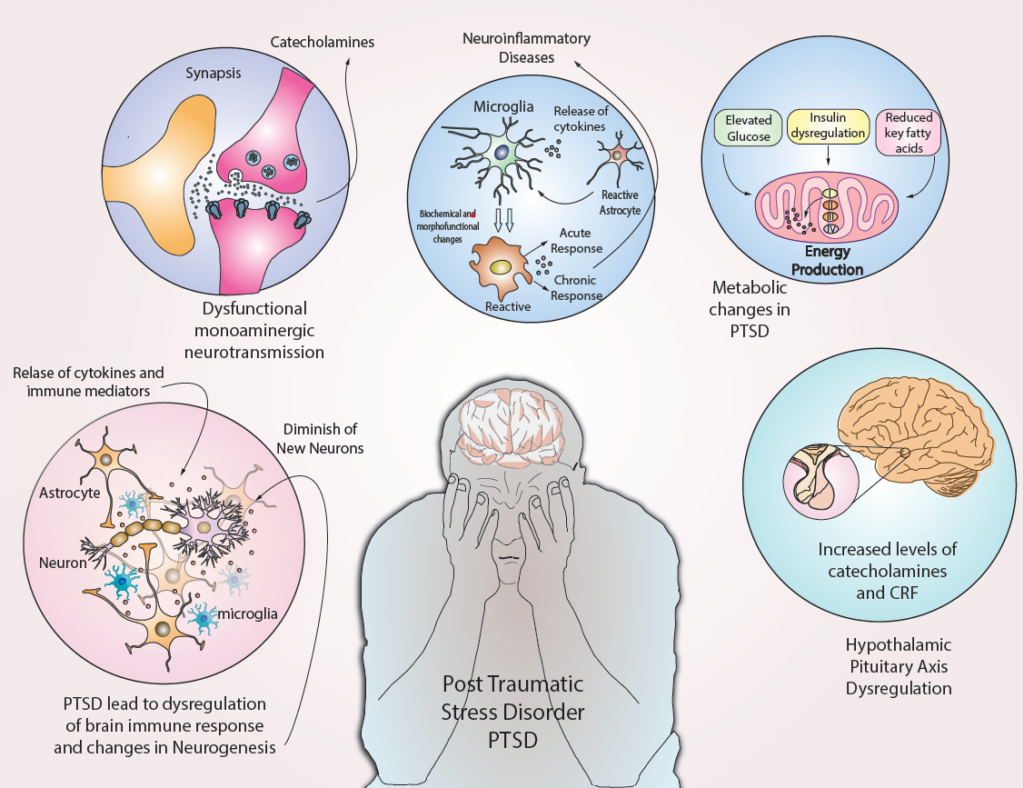
Иммунный дисбаланс и воспаление сопровождают такие нарушения психического здоровья, как MDD (Major Depressive disorder), шизофрению, биполярное расстройство, расстройство аутистического спектра и ПТСР. Все большее число исследований показывает, что у людей с ПТСР значительно повышен уровень в крови таких маркеров воспаления, таких как IL-1β, IL-6, TNF-α и CRP.
Нейроэндокринный ответ на стресс реализуется двумя системами:
• Автономной Нервной Системой (ANS) (состоящей из симпатической SNS и парасимпатической PNS)
• Гипоталамо-гипофизарно-надпочечниковой осью (HPA Axis)
CRH кортикотрофин-рилизинг гормон, ACTH адренокортикотропный гормон, NF-κB ядерный фактор-κB, IL-1 интерлейкин-1, IL-6 интерлейкин-6.
Предположительный сценарий, объясняющий, как стресс-индуцированные реакции этих систем приводят к усилению воспаления, показан на двух рисунках.
Цитокины - это сигнальные молекулы, синтезируемые и секретируемые несколькими типами клеток, включая периферические иммунные клетки (например, макрофаги, лимфоциты), эндотелиальные клетки сосудов и микроглии, астроциты и нейроны центральной нервной системы (ЦНС).
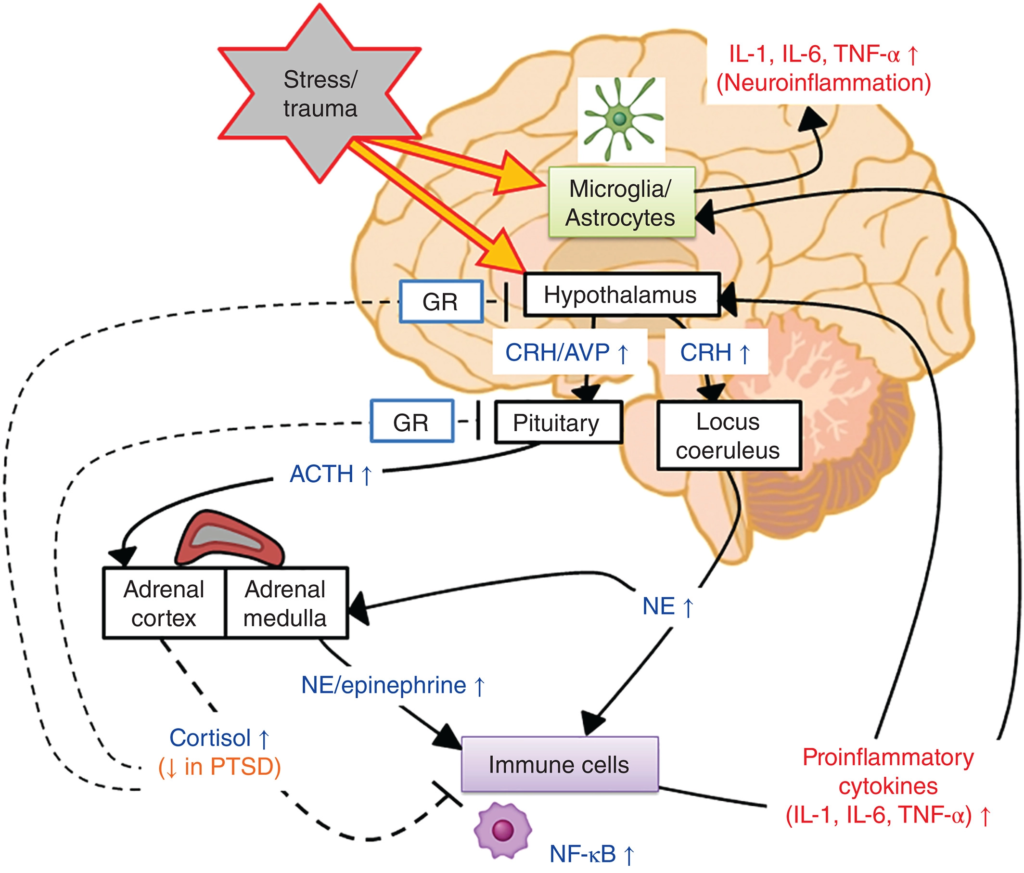
ACTH — адренокортикотропин; AVP — аргинин-вазопрессин; CRH — кортикотропин-рилизинг гормон; GR — глюкокортикоидный рецептор; NE — норадреналин; NF-κB — ядерный фактор-κB; IL — интерлейкин; TNF-α — фактор некроза опухоли α.
Стресс увеличивает синтез и высвобождение кортикотропин-рилизинг гормона (Corticitropin-Releasing Hormone) и аргинин-вазопрессина (AVP) в паравентрикулярном ядре гипоталамуса. CRH стимулирует SNS к выработке катехоламинов, включая норадреналин (который приводит к ряду симптомов ПТСР, таких как чрезмерное возбуждение, hyperarousal). Этот повышенный выброс норадреналина может вызвать выработку провоспалительных цитокинов, таких как IL-1 и IL-6, через ядерный фактор-κB (NF-κB)-зависимый и другие механизмы (хотя взаимодействие между вегетативной нервной системой и иммунной системой может быть гораздо более сложным). Эти цитокины, в свою очередь, стимулируют секрецию CRH из паравентрикулярного ядра гипоталамуса.
Что касается (ре)активности оси HPA, то повышенный CRH обычно стимулирует секрецию адренокортикотропина и, следовательно, вызывает повышение кортизола; однако при ПТСР большое количество данных свидетельствует о снижении кортизола на фоне повышенного CRH. И это очень интересный момент – у HPA есть система саморегулирования по принципу отрицательной обратной связи (negative feedback), когда глюкокортикоиды (тот же кортизол) связываются с глюкокортикоидными рецепторами (GR) в гипоталамусе и гипофизе. Комплекс глюкокортикоид-GR также подавляет воспалительные реакции либо путем стимуляции транскрипции противовоспалительных генов в ядре, либо путем подавления экспрессии провоспалительных белков в цитозоле. Однако хроническое воздействие стресса может привести к глюкокортикоидной резистентности, когда кортизол не может подавить выброс провоспалительных цитокинов, ослабляя глюкокортикоидную отрицательную обратную связь оси HPA (рисунок 1, внизу справа)
Гипокортизолизм в сочетании с повышенной чувствительностью к GR является отличительной особенностью ПТСР, что может показаться на первый взгляд парадоксальным, учитывая, что повышенная активность оси HPA ожидается как следствие сильного стресса. Стресс = высокий кортизол, но, как оказівается, далеко не всегда. Кроме того, депрессивные расстройства, которые часто сопутствуют ПТСР, обычно ассоциируются с гиперкортизолизмом наряду со снижением чувствительности ГР.75 Поэтому, если ПТСР имеет большую (или уникальную) воспалительную патологию, чем другие психические расстройства, связанные со стрессом, отличительный паттерн изменения функции оси HPA может быть ключом к разгадке.
Нейровоспаление
Учитывая преобладающее в настоящее время определение ПТСР как расстройства работы мозга (brain disorder), ключевым понятием здесь будет «нейровоспаление», или воспаление нервной ткани. Мозг когда-то считался «иммунопривилегированным» органом, что означает, что клетки иммунной системы не проникают в мозг, за исключением некоторых случаев заболеваний и травм. Однако впоявляется все больше доказательств того, что мозг и иммунная система регулярно взаимодействуют как при болезни, так и в здоровом состоянии. Периферические провоспалительные цитокины могут воздействовать на мозг через несколько механизмов, в том числе посредством активного транспорта через гематоэнцефалический барьер (ГЭБ), через негерметичные участки ГЭБ (leaky regions) (Рисунок 3 и 4) или через активацию нейронных путей, таких как блуждающий нерв. Таким образом, воспаление как на периферии, так и в ЦНС может способствовать нейровоспалению через активацию микроглии и астроцитов.
Микроглия, основные клетки врожденного иммунитета в ЦНС, являются ключевыми медиаторами нейровоспалительных процессов. У неё есть режимы активации и покоя зависящие от воспалительной среды. Физиологические функцие микроглии включают синаптогенез, трофическую поддержку, хемотаксис и нейрогенез. Однако микроглия может утратить эти гомеостатические функции в ходе многих заболеваний. При болезни и стресса микроглия может оставаться в активированном состоянии,тем самым перепроизводя цитотоксические молекулы, такие как провоспалительные цитокины и глутамат. Эти провоспалительные медиаторы, вырабатываемые активированной микроглией, активируют астроциты, которые также выделяют цитокины и вызывают дальнейшую активацию микроглии; таким образом, связь между микроглией и астроцитами может усиливать провоспалительный сигналинг, инициированный микроглией. Связанные с заболеванием реакции микроглии и астроцитов могут в конечном итоге привести к функциональным/структурным изменениям мозга и поведенческим изменениям, связанным с ПТСР.
В целом, воспалительное состояние при ПТСР развивается благодаря сочетанию глюкокортикоидной резистентности с повышенной активностью симпатической и пониженной активностью парасимпатической нервной системы.
Коморбидность
ПТСР может быть коморбидным с серьезными физическими заболеваниями, включая астму, аутоиммунные заболевания, такими, как воспалительные заболевания кишечника (ВЗК), ревматоидный артрит (РА), рассеянный склероз (РС) и псориаз, а также сердечно-сосудистыми заболеваниями.
Противовоспалительные терапевтические подходы
В настоящее время только два селективных ингибитора обратного захвата серотонина (СИОЗС или SSRI), пароксетин и сертралин, одобрены FDA для лечения ПТСР. Тем не менее, частота ответа на эти препараты ниже 65%. Учитывая воспалительную характеристику ПТСР, перспективными представляются стратегии, уменьшающие воспаление и/или его влияние на мозг, в сочетании с SSRI и поведенческими подходами.
Нестероидные противовоспалительные препараты (НПВП), которые используются для лечения и облегчения различных заболеваний и состояний, оказывают противовоспалительное действие путем ингибирования фермента циклооксигеназы 2 (COX-2)), участвующего в выработке цитокинов.
Моноклональные антитела к цитокинам и их рецепторам, включая TNF, IL-1, IL-6R, IL-12/23 и IL-17. Учитывая повышенный уровень IL-1β, IL-6 и TNF-α при ПТСР, блокирование этих цитокинов может быть простой стратегией лечения проверенными (на лечении аутоиммунных заболеваний и рака) средствами.
Глюкокортикоиды, или стероиды, благодаря мощному иммунодепрессивному действию. Недавно большой мета-анализ рандомизированных контролируемых исследований глюкокортикоидной терапии сообщил, что, хотя лечение глюкокортикоидами облегчает симптомы ПТСР, профилактический прием глюкокортикоидов после острой травмы более эффективен.
Ингибиторы ангиотензин-превращающего фермента (ACE-I) и блокаторы рецепторов ангиотензина (ARBs) можно также использовать как противовоспалительные терапевтические стратегии, учитывая их эффективность в лечении кардиометаболических расстройств, которые часто сопутствуют ПТСР.
Норадренергические блокаторы бета-рецепторов (например, пропранолол) за счёт их подавления норадреналинового сигналинга, который способствует выработке провоспалительных цитокинов. Было также показано, что блокада норадренергических бета-рецепторов препятствует реконсолидации воспоминаний о страхе (fear memory).
Каннабиноиды также рассматриваются для лечения ПТСР благодаря их противовоспалительному действию. Эндоканнабиноидная (eCB) сигнализация от клеток макрофагов и моноцитов, включая микроглию в мозге, участвует в воспалительных процессах, связанных с ПТСР.
Помимо фармакологических средств, в исследованиях сообщалось о потенциально благотворном влиянии ЗОЖ, включая физические упражнения и диету, включая употребление таких продуктов, как рыбий жир и напитки с лактобактериями. Исследования показали, что микробиота кишечника играет важную роль во взаимодействии между желудочно-кишечным трактом и ЦНС (т.е. ось «кишечник-мозг» — gut-brain axis), в котором иммунная система выступает в качестве ключевого регулятора. Микробиом кишечника влияет на активацию периферических иммунных клеток, участвующих в нейровоспалении, а также влияет на созревание микроглии в ЦНС.